Introduction
 L’hypertension est la maladie cardiovasculaire la plus importante du chat âgé et la maladie vasculaire la plus importante du chat en général, représentant environ 1 % des admissions au NCSU entre 1990 et 1995 (Figure 1). Son identification et son traitement prennent donc logiquement une place cruciale dans la pratique de la médecine féline gériatrique.
L’hypertension est la maladie cardiovasculaire la plus importante du chat âgé et la maladie vasculaire la plus importante du chat en général, représentant environ 1 % des admissions au NCSU entre 1990 et 1995 (Figure 1). Son identification et son traitement prennent donc logiquement une place cruciale dans la pratique de la médecine féline gériatrique.
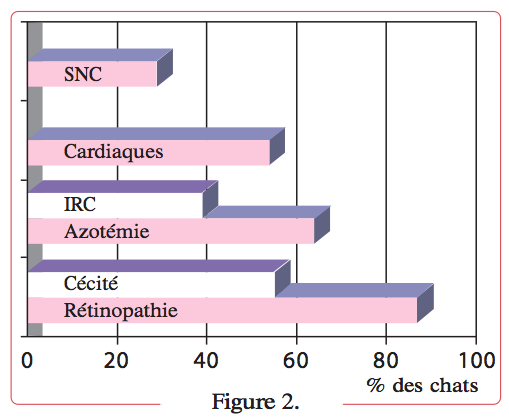
Les organes cibles de l’hypertension systémique sont nombreux (Figure 2).
Notre expérience a montré que les chats hypertendus souffrent d’une atteinte associée des organes suivants, dans l’ordre approximatif de présentation clinique : yeux, reins, cœur et système nerveux central (SNC) 1.
Toute discussion sur la prise en charge de l’hypertension doit être précédée d’une discussion sur les causes de l’hypertension, les organes cibles spécifiques atteints, et le mécanisme d’atteinte des organes cibles.
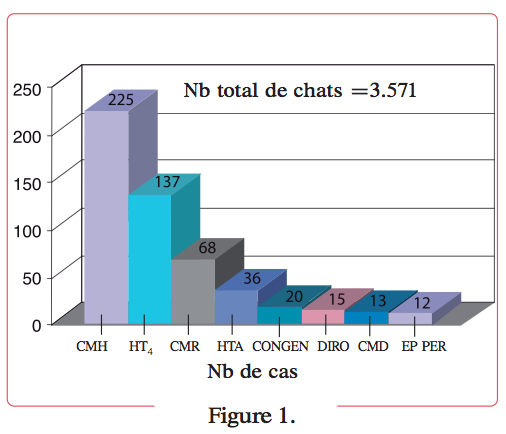
Définition figure 1.
Prévalences relatives des cardiomyopathies et de l’hyperthyroïdie observées au NCSU sur une période de 5 ans.
- CMH= cardiomyopathiehypertrophique.
- HT4=hyperthyroïdie.
- CMR= cardiomyopathie restrictive.
- HTA=hypertension artérielle systémique.
- CONGEN=cardiopathies congénitales.
- DIRO=dirofilariose.
- CMD=cardiomyopathie dilatée.
- EP PER=épanchement péricardique.
Étiologie
L’hypertension chez l’animal a largement été considérée comme secondaire à d’autres maladies (insuffisance rénale, dysendocrinies, par exemple), par opposition à l’hypertension idiopathique (primaire ou essentielle) qui représente la majorité des cas d’hypertension chez l’Homme.
Cette notion est actuellement remise en question. Une étude menée chez des chats hypertendus référés pour trouble oculaire a révélé qu’au moins 17 % – et peut-être jusqu’à 50 % – d’entre eux ne présentaient aucune cause identifiable à leur hypertension systémique 1. Une autre étude a montré qu’environ 20 % des chats hypertendus, diagnostiqués en clientèle généraliste, étaient des cas idiopathiques 2.
Dans une étude rétrospective sur l’hypertension féline réalisée avec des critères d’inclusion plus rigoureux (Atkins, Grauer, non publiée), plus de 10 % des chats étaient identifiés comme idiopathiques. Il est important de noter que l’âge moyen des chats hypertendus est de 14,8 ans 1.
Les causes établies et possibles de l’hypertension secondaire incluent l’insuffisance rénale aiguë et chronique, l’hyperthyroïdie, l’hypothyroïdie, l’hypercorticisme, l’hyperaldostéronisme, le phéochromocytome, le diabète sucré et éventuellement l’obésité. L’insuffisance rénale chronique (IRC) est clairement la première pathologie associée à l’hypertension et en est souvent la cause. Selon un récent article, environ 29 % des chats âgés souffrant d’IRC seraient hypertendus 3, ce pourcentage variant de 19 à 65 % selon quatre autres études 4.
Points clefs
Un examen du fond d’œil et une mesure de la pression artérielle doivent être réalisés chez tous les chats âgés de plus de 10 ans.
Chez certains chats, l’hypertension n’a pas de cause identifiable. Ces cas doivent être considérés comme idiopathiques et traités de manière agressive pour prévenir une atteinte des organes cibles.
Il est impératif d’intervenir tôt, notamment pour épargner les yeux et le système nerveux central, et l’amlodipine est le traitement de choix.
Chez la plupart des chats hypertendus, le système rénine-angiotensine-aldostérone est anormalement activé et doit être inhibé à l’aide d’un IECA ou d’un antagoniste de l’aldostérone. La tachycardie contribue non seulement à l’hypertension, mais elle est également néfaste pour le système cardiovasculaire ; toute tachycardie persistante doit être traitée avec l’aténolol.
Pathogénie
La pathogénie de l’hypertension est complexe et encore mal connue, et dépasse le cadre de cet article. Toutefois, plusieurs études ont indiqué que le système rénine- angiotensine-aldostérone (SRAA) est probablement anormalement activé chez une grande – si ce n’est une majeure – partie des chats souffrant d’hypertension systémique, notamment lors d’insuffisance rénale concomitante, et sans aucun doute après l’administration de médicaments tels que les diurétiques de l’anse et les vasodilatateurs 4-6.
Mon approche thérapeutique se base sur l’atteinte des organes cibles (présente ou absente, et si présente, nature du (des) système(s) organique(s) compromis), et il convient de lister rapidement les organes cibles de l’hypertension et leurs mécanismes d’atteinte.
Les tissus tels que l’œil, le cerveau et le rein sont capables de protéger leur microcirculation des variations de pression grâce à un système « d’autorégulation ». Chez l’individu sain, la pression glomérulaire est maintenue entre 60 et 160 mmHg. Toutefois, en cas d’hypertension, cette protection disparaît et les pressions systémiques élevées sont directement transmises aux lits capillaires, provoquant ainsi des barotraumatismes.
Atteinte oculaire
L’œil est l’organe le plus à risque, en raison de sa sensibilité aux agressions. L’hypertension provoque une rupture des « barrières hémato-oculaires » et engendre une vasoconstriction « protectrice », suivie d’une hypertrophie/ hyperplasie vasculaire secondaire et d’une dysfonction vasculaire avec passage d’éléments sanguins dans les tissus et liquides oculaires.
Les signes cliniques incluent
- sinuosité des artérioles
- œdème
- hémorragie
- décollement de la rétine
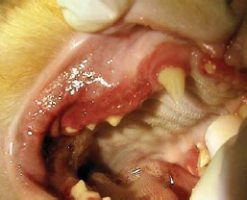
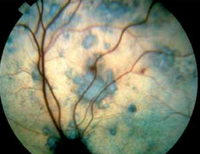
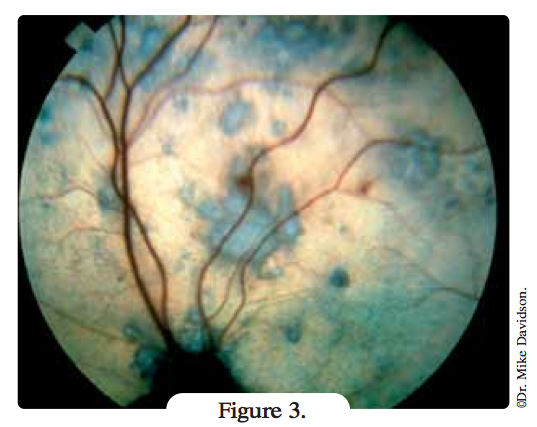
- hyphéma (Figure 3)
Une cécité se développe souvent, conséquence des complications de l’hémorragie intra-oculaire (décollement rétinien, cataracte, hémorragie vitréenne extensive, et glaucome secondaire) ou plus fréquemment d’une dégénérescence progressive de la rétine neurosensorielle. La cécité est généralement, mais pas toujours, permanente.
Si la vue est recouvrée, cela peut être temporaire ; en effet, une dégénérescence rétinienne due à une lésion ischémique progressive ou une excitotoxicité peut se développer, parfois au bout de plusieurs mois.
La détection précoce de la rétinopathie hypertensive est essentielle, ce qui pèse en faveur d’un examen ophtalmologique annuel chez le chat âgé.
Atteinte rénale
La perte d’autorégulation rénale entraîne une augmentation de la pression capillaire intraglomérulaire et une destruction rénale progressive. Cela peut arriver lors d’insuffisance rénale aiguë ou chronique et, pour compliquer encore la pathogénie de la néphropathie hypertensive, l’insuffisance rénale entraîne une hypertension qui elle-même entraîne une insuffisance rénale.
En outre, l’activation du SRAA contribue à l’atteinte rénale. Il a été démontré, sans surprise, que les IECA permettaient d’épargner le rein via une diminution des pressions intraglomérulaires, une inhibition de la croissance et de la fibrose des cellules mésangiales et probablement via une réduction de la protéinurie. Les artères et artérioles rénales sont elles-mêmes lésées et contribuent à la pathogénie de la maladie (voir para- graphe « atteinte vasculaire », ci-après).
Le rein, comme l’œil, est un organe cible important de l’hypertension, même lorsque l’hypertension est secondaire à une insuffisance rénale. L’insuffisance rénale étant un problème majeur pour la population des chats âgés, la correction de l’hypertension peut permettre d’améliorer la durée et la qualité de vie des animaux. Il est essentiel de réaliser au moins une fois par an chez ces chats un examen du fond d’œil, une analyse urinaire, un dépistage de la micro-albuminurie et un dosage de l’urée et de la créatinine sériques, associés à une mesure de la pression artérielle (PA) systémique.
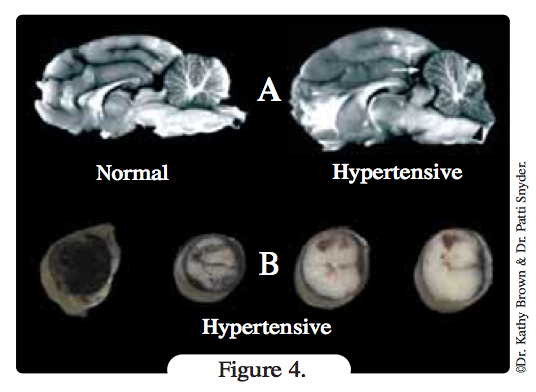
Atteinte du SNC? Lors d’hypertension, le SNC perd également sa capacité d’autorégulation. La pression artérielle cérébrale est normalement maintenue entre 60 et 150 mmHg, mais les pressions supérieures altèrent les vaisseaux, entraînant lésions et perméabilité vasculaires, œdème cérébral, voire hernie du tronc cérébral (Figure 4a). L’hyperperfusion induite par l’hypertension contribue également à l’œdème. Les barotraumatismes vasculaires peuvent entraîner une ischémie, et une hémorragie du tronc cérébral ou de la moelle épinière (Figure 4b). Les signes cliniques peuvent inclure des lésions des nerfs crâniens, des convulsions, une somnolence, une paralysie/parésie et des troubles du comportement.
Atteinte vasculaire? L’hypertension provoque une dysfonction endothéliale avec altération de la vasodilatation, ce qui aggrave encore l’hypertension. Avec le temps, une artériosclérose et une hyperplasie myointimale se développent, altérant la capacité des vaisseaux à protéger les autres organes cibles par autorégulation. Le contrôle de la PA seul ne permet pas d’inverser ces modifications, mais la baisse de la PA associée à l’inhibition du SRAA permet de normaliser à la fois le fonctionnement et l’anatomie vasculaires 7.
Atteinte cardiaque? L’hypertension et les modifications vasculaires concomitantes entraînent une augmentation de la post-charge cardiaque.
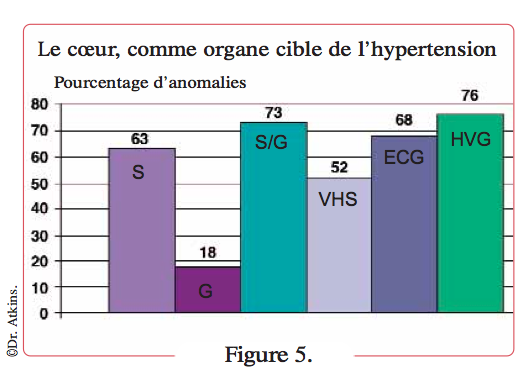
À cela s’ajoute une activation du système nerveux sympathique (SNS). Hypertrophie et fibrose cardiaques sont la conséquence de l’hypertension (augmentation de la post-charge) associée à l’activation du SRAA et du SNS. Une analyse réalisée sur 99 chats (Atkins, données non publiées) a révélé que la grande majorité des animaux présentaient des anomalies cardiaques (Figure 5), incluant anomalies auscultatoires (souffle et/ou galop), cardiomégalie, hypertrophie ventriculaire gauche et/ou signes électrocardiographiques de cardiopathie hypertensive. Mais seulement 3 % de ces chats ont développé une insuffisance cardiaque.
Définition figure 4
- A: Coupes sagittales de cerveau chez un chat sain (à gauche) et un chat souffrant d’hypertension aiguë. Un œdème cérébral est présent et le cervelet hypertrophié fait protrusion dans le trou occipital produisant une formation en « cône ».
- B: Hémorragie médullaire d’origine hypertensive. Notez que l’hémorragie est à la fois sous-durale et intrathécale.
Définition figure 5
Anomalies cardiaques observées chez 99 chats hypertendus. Notez la forte prévalence des anomalies cardiaques.
- S=souffle.
- G= galop.
- S/G=souffle et galop.
- VHS=score vertébral (Vertebral Heart Score).
- ECG=anomalie électrocardiographique.
- HVG=hypertrophie du ventricule gauche identifiée à l’échographie.
Diagnostic de l’hypertension
Bien qu’une discussion détaillée sur le diagnostic de l’hypertension dépasse le cadre de cet article, il convient de faire un bref récapitulatif. Les vétérinaires utilisent majoritairement la méthode Doppler pour déterminer la pression artérielle chez le chat. Cette technique, bien que jugée plus fiable que la méthode oscillométrique chez les animaux de petite taille, possède le gros inconvénient de ne pas permettre d’obtenir de pressions diastoliques ou moyennes, dans la plupart des cas. C’est pour cette raison que nous continuons d’évaluer le matériel oscillométrique, et les nouvelles unités se révèlent prometteuses pour une utilisation chez les petits chiens et chats.
Au NCSU, la queue est considérée comme le site de choix pour la mesure de la PA, suivie de la face palmaire de l’extrémité du membre antérieur et enfin de la face dorsale de l’extrémité du membre postérieur. La largeur du brassard est importante et doit représenter environ 30 à 40 % de la circonférence de l’extrémité utilisée.
Les brassards trop petits ont tendance à entraîner une sur- estimation de la pression artérielle systémique réelle et les brassards trop grands une sous-estimation. Le brassard doit être placé approximativement au même niveau que le cœur. Selon les recommandations actuelles, la pression artérielle doit être mesurée dans un environnement calme, avant l’examen clinique, généralement en présence du propriétaire et après 5 à 10 minutes d’acclimatation.
Les membres du panel Hypertension de l’ACVIM suggèrent de ne pas tenir compte de la première mesure, et d’en réaliser au moins 3 autres, de préférence entre 5 et 7, jusqu’à ce que les mesures successives de la PA systolique varient entre elles de moins de 20 %. Les conditions de mesure (l’état émotionnel de l’animal, taille du brassard, le site de mesure ainsi que tous les résultats) doivent être consignées dans le dossier médical.
De nombreux vétérinaires ne posent un diagnostic d’hypertension qu’après avoir observé à plus d’une reprise des valeurs élevées de pression artérielle. Signalons que le risque de diagnostic « faux positif » est augmenté chez les animaux de moins de 10 ans, en particulier chez le chat où un effet « blouse blanche » (hypertension de stress) est couramment observé chez les chats « normo-tendus ». Ce risque de faux diagnostic est réduit si des prédispositions (insuffisance rénale, par exemple) ou des anomalies concomitantes (rétinopathie ou souffle, par exemple) sont détectées.
Quels sont les médicaments utilisables ?
Les traitements de l’hypertension féline sont nombreux et ont rarement fait l’objet d’une évaluation systématique.
Les médicaments utilisés ou décrits incluent :
- Les diurétiques (furosémide et spironolactone).?
- Les inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA) (captopril, énalapril, lisinopril).
- Les bêta-bloquants (propanolol et aténolol).?
- Les inhibiteurs des canaux calciques (diltiazem et amlodipine).
Différentes études ont évalué différents schémas thérapeutiques ; la littérature et l’expérience clinique nous amènent à conclure que l’amlodipine est le seul traitement vraiment efficace pour la prise en charge de l’hypertension systémique féline 1, 8-11. Cependant, des rôles spécifiques sont attribués à d’autres médicaments ; les bêta-bloquants permettent de ralentir la fréquence cardiaque et d’inhiber les effets cardio-vasculaires de la T3 lors d’hyperthyroïdie ; les IECA permettent de lutter contre l’activation spontanée ou iatrogène du SRAA, de maintenir la fonction rénale 12, 13, et de réduire la PA 14, 15 ; la spironolactone a des effets anti-aldostérone 16 ; et le furosémide (éventuellement associé à la nitroglycérine) soulage l’insuffisance cardiaque d’origine hypertensive.
Comment traiter l’hypertension ?
Il est important de prendre en compte les facteurs suivants
- déterminer si le SRAA est activé (de façon primaire ou iatrogène) ;
- évaluer le rôle du SNS ;
- évaluer la fonction rénale et les effets de l’hypertension sur la fonction rénale ;
- observer l’apport sodé ; rechercher la présence d’une insuffisance cardiaque (rare) ;
- explorer les causes réversibles d’hypertension (hyperthyroïdie, diabète sucré, tumeurs surrénaliennes, par exemple) ;
- et identifier le(s) organe(s) cible(s) touché(s) ou supposés à risque.
Je classe essentiellement les chats de la manière suivante :
- cause réversible ou irréversible ;
- avec ou sans activation présumée du SRAA (activation lors d’insuffisance rénale, d’insuffisance cardiaque, d’administration de vasodilatateurs ou de diurétiques de l’anse) ;
- présence ou absence de tachycardie (> 200 bpm) ; et par atteinte des organes cibles.
Dans tous les cas, j’utilise un aliment modérément réduit en sel (aliment à visée rénale habituellement) et j’évite les solutés salés, comme le Ringer lactate. Cela permet de diminuer la charge sodée totale de l’organisme sans aggraver la fonction rénale ou suractiver le SRAA, ce qui peut arriver avec les aliments à teneur très réduite en sodium.
Je n’ignore pas que la restriction sodée a peu, voire pas du tout, d’effet sur la pression artérielle chez le chat, mais il a été démontré que le sel joue un rôle favorisant dans les cardiopathies hypertensives.
L’hyperthyroïdie, seule cause traitable fréquente d’hypertension féline, se traite par les méthodes standards. Mais à cause des effets de la T3 sur les récepteurs bêta, j’utilise un bêta-bloquant, comme l’aténolol (à raison de 6,25 à 12,5 mg/j PO), pour inverser les effets cardio- vasculaires de l’hyperthyroïdie jusqu’à ce que le traitement étiologique se montre efficace, et si le contrôle de l’hypertension est insuffisant, j’ajoute l’énalapril à raison de 0,5 mg/kg/j PO.
Chez le chat hypertendu euthyroïdien non tachycarde, je simplifie l’approche en administrant quotidiennement de l’amlodipine et de l’énalapril, un comprimé le matin et un comprimé le soir, si l’emploi du temps du propriétaire le permet. Si le contrôle de la pression artérielle est insuffisant, j’augmente d’abord la posologie de l’amlodipine et/ou j’utilise d’autres médicaments (bêta-bloquants, par exemple). S’il y a un problème d’observance et qu’il ne peut être administré qu’un seul comprimé par jour, l’amlodipine sera le traitement de choix.
Atteinte des organes cibles
Basée sur les lésions des organes cibles, mon approche thérapeutique consiste à utiliser l’amlodipine comme seul traitement initial lorsque les barotraumatismes eux-mêmes constituent a priori les effets les plus dommageables (lésions du SNC, des yeux) et qu’une réduction aiguë de la pression artérielle est nécessaire.
Les IECA sont rajoutés ensuite.
Si les reins, les vaisseaux sanguins ou le cœur semblent plus à risque, alors j’inhibe le SRAA, généralement avec un IECA (énalapril, par exemple), les bêta-bloquants ou l’amlodipine n’étant rajoutés que si une baisse supplémentaire de la pression artérielle est nécessaire (Figure 6).
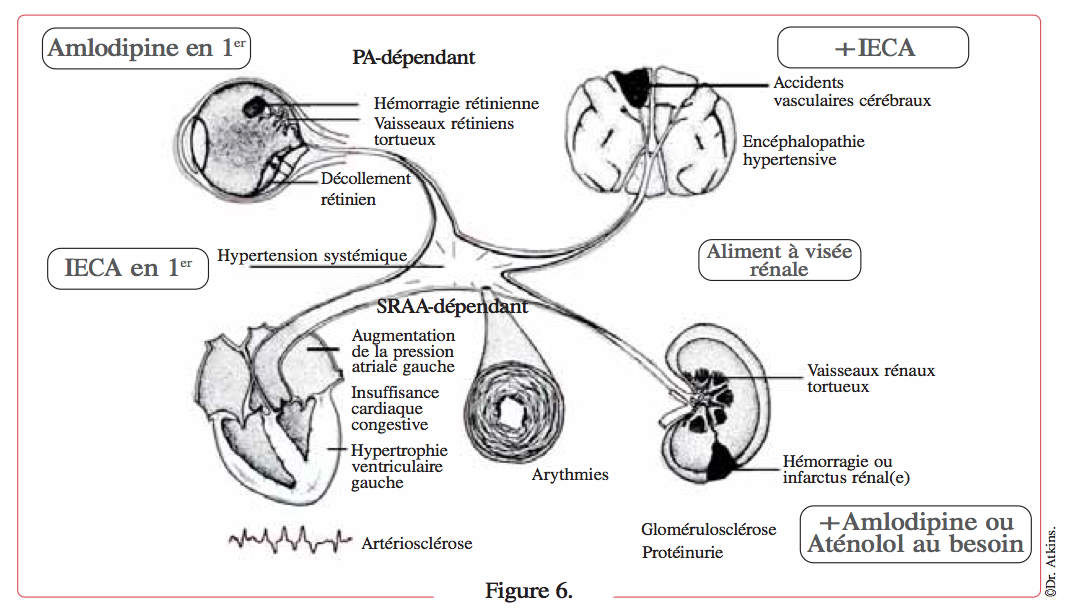
Les organes les plus sensibles aux barotraumatismes, en l’absence d’implication claire du SRAA, sont l’œil et le cerveau. Le risque pour ces organes est généralement plus aigu, et il est souhaitable de réduire immédiatement la pression artérielle en utilisant l’amlodipine ; un IECA peut être ajouté dans le même temps ou plus tard.
Pour les organes comme le cœur, les artères et le rein, le risque aigu est moindre et le SRAA joue un rôle important dans l’atteinte de ces organes cibles. C’est pour cela qu’un IECA est administré en premier, même si la baisse de la pression artérielle risque fort de ne pas être suffisante.
L’amlodipine (pour garantir une réduction de la PA) ou l’aténolol (pour diminuer la fréquence cardiaque) peuvent être ajoutés selon les besoins.
Enfin, une restriction modérée de l’apport sodé est mise en œuvre.
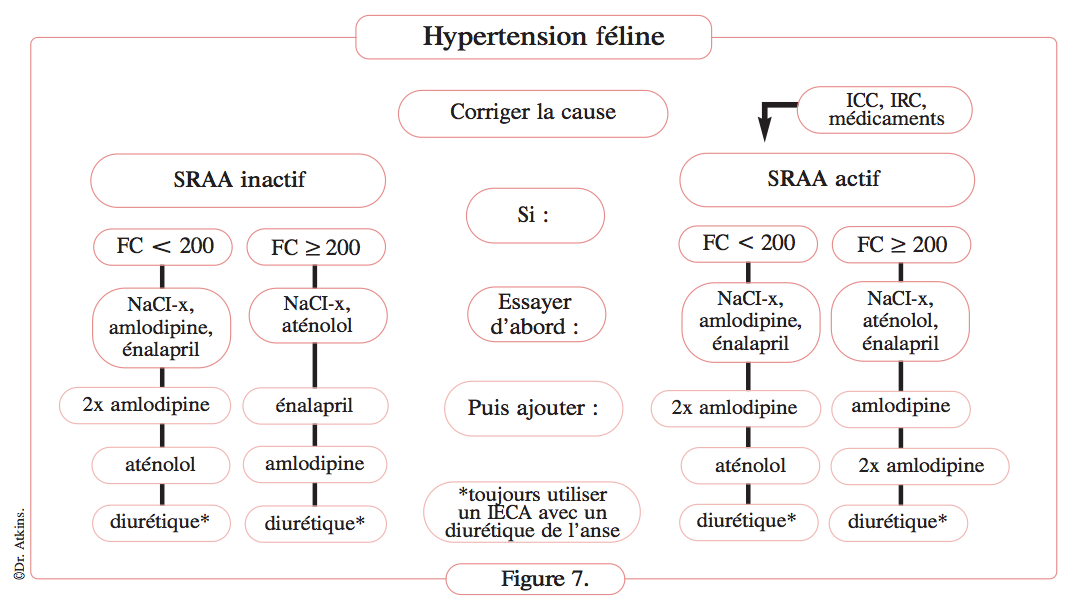
Définition figure 7
Arbre décisionnel pour une approche thérapeutique de l’hypertension féline basée sur l’activation du SRAA et la fréquence cardiaque, prenant également en compte l’atteinte des organes cibles. Si le vétérinaire n’est pas sûr de l’état d’activation du SRAA, l’approche la plus sûre consiste à supposer qu’il est activé.
- NaCl-x=restriction sodée modérée ;
- FC=fréquence cardiaque ;
- ICC=insuffisance cardiaque congestive ;
- IRC=insuffisance rénale chronique.
• Activation du SRAA
Le SRAA est probablement activé chez la majorité ou la totalité des chats hypertendus. C’est pour cette raison que les IECA sont utilisés dans la plupart des cas d’hypertension, même s’ils ne sont pas les plus efficaces pour diminuer la pression artérielle. L’emploi de ces médicaments est particulièrement pertinent quand on sait que l’amlodipine active à la fois le SRAA (6) et le SNS (17). Les bêta-bloquants sont utilisés si une tachycardie persistante est observée ou, comme indiqué précédemment, lors d’hyperthyroïdie concomitante.
• SRAA non activé
Si le SRAA ne semble pas activé (hypothèse pouvant se révéler fausse) et si la tachycardie n’est pas un problème, mon approche est la suivante : amlodipine (0,625 à 1,25 mg/j PO, voire plus en cas de non-réponse) plus aliment à visée rénale modérément réduit en sel et énalapril (Figure 7). L’IECA permet de neutraliser l’activation du SRAA induite par l’amlodipine (6). Si cela ne suffit pas, je commence par doubler la posologie de l’amlodipine, puis par étape je rajoute de l’aténolol et enfin (rarement) des diurétiques (furosémide à raison de 6,25 à 12,5 mg/j ou spironolactone à raison de 1 à 2 mg/kg/j PO), si nécessaire. Soulignons qu’en cas de non- réponse à l’amlodipine associée à un second médicament, l’observance du propriétaire et la technique de mesure de la PA doivent être examinées.
En présence d’une tachycardie (sans activation du SRAA), je commence avec une restriction sodée modérée et de l’aténolol. Cependant, même si la fréquence cardiaque diminue généralement, le contrôle de la PA se montre souvent insuffisant, et j’ajoute alors par étape l’amlodipine plus l’énalapril, puis, au besoin, je double la posologie de l’amlodipine et, enfin (rarement) j’ajoute un diurétique. En revanche, si la tachycardie n’est pas initialement contrôlée, je double d’abord la dose d’aténolol. Si cela ne permettait pas de ramener la fréquence cardiaque < 160 à la clinique ou < 140 à la maison, je remplacerais alors l’amlodipine par le diltiazem (30 mg PO deux fois par jour) pour mieux contrôler la fréquence cardiaque et je suivrais ensuite les étapes précédemment citées.
• SRAA anormalement activé
Quand les circonstances (insuffisance cardiaque, insuffisance rénale ou traitement médicamenteux) indiquent que le SRAA est anormalement activé, je commence le traitement avec l’amlodipine, un aliment modérément réduit en sel et l’énalapril (Figure 7). Si la PA ne se normalise pas, par étape, j’augmente la posologie d’amlodipine en premier, puis je rajoute l’aténolol et enfin des diurétiques (furosémide ou spironolactone). En revanche, si la tachycardie est un problème, j’utilise initialement une restriction sodée modérée, l’aténolol et l’énalapril.
Si le contrôle de l’hypertension se révèle insuffisant, je rajoute l’amlodipine, puis par étape, je double la posologie d’amlodipine et enfin j’ajoute des diurétiques si nécessaire. Si après le traitement initial, la fréquence cardiaque ne se normalise pas, j’augmente d’abord la dose d’aténolol. Si cela ne suffit pas, je remplace alors l’amlodipine par du diltiazem longue action (30 mg PO deux fois par jour) pour mieux contrôler la fréquence cardiaque et je suis ensuite les étapes précitées du contrôle de la PA si nécessaire. L’insuffisance cardiaque secondaire d’origine hypertensive est rare et ne sera pas abordée ici, sauf pour dire que les diurétiques seront souvent nécessaires dans ce cas pour contrôler les signes cliniques et que l’énalapril sera indiqué.
Pour finir, s’il existe une insuffisance rénale ou une néphropathie significative, l’étiologie doit en être recherchée (au moins par une analyse et une culture urinaires) en espérant identifier une cause réversible. Par ailleurs, le traitement de l’insuffisance rénale est standard et dépasse le cadre de cet article. Il est prudent de prendre en compte les voies d’excrétion des médicaments utilisés pour décider de la posologie et de la fréquence des administrations en cas d’insuffisance rénale.
Notons qu’une hypotension se développe rarement à la suite d’un traitement anti-hypertenseur excessif. Elle doit être toutefois évitée car elle risque d’aggraver la dysfonction rénale préexistante.
Pronostic et conclusion
Le pronostic de l’hypertension féline est réservé mais pas sombre. La vue, une fois perdue, est rarement recouvrée. Toutefois, avec un diagnostic et un traitement adaptés, les survies moyennes observées varient entre 18 et 21 mois à partir de la date du diagnostic 1, 3. La comparaison des données de survie des chats souffrant de cardio-myopathie hypertrophique (âge moyen : 6,5 ans) 18 et des chats traités pour hypertension (âge moyen : 14,8 ans) 1 montrent que les survies ne sont pas très différentes malgré les différences d’âge des chats.
Cela prouve qu’il faut être vigilant afin de pouvoir détecter et traiter le plus tôt possible l’hypertension chez le chat âgé, le mieux étant pour cela de réaliser des examens cliniques tous les six mois avec examen du fond d’œil et mesure de la PA chez tous les chats de plus de 10 ans.
Références
- Maggio F, DeFrancesco TC, Atkins CE, et al. Ocular lesions associated with systemic hypertension in cats: 69 cases (1985-1998). J Am Vet Med Assoc 2000; 217: 695-702.
- Elliott J, Fletcher M, Syme H. Idiopathic feline hypertension: Epidemio- logical study. J Vet Intern Med 2003;17:254.
- Elliott J, Rawlings PJ, Markwell PJ, et al. Incidence of hypertension in cats with naturally-occuring chronic renal failure. J Vet Intern Med 1999; 13:251.
- Brown S, Atkins C, Bagley R, et al. Guidelines for the identification, evalu- ation, and management of systemic hypertension in dogs and cats. J Vet Intern Med 2007;21:542-558.
- Haggstrom J, Hansson K, Karlberg BE, et al. Effects of long-term treatment with enalapril or hydralazine on the renin-angiotensin-aldosterone system and fluid balance in dogs with naturally acquired mitral valve regurgitat- ion. Am J Vet Res 1996;57:1645-1652.
- Atkins CE, Rausch WP, Gardner SY, et al. The effect of amlodipine and the combination of amlodipine and enalapril on the renin-angiotensin- aldosterone system in the dog. J Vet Pharm Ther 2007;30:394-400.
- Schiffrin EL, Park JB, Intengan HD, et al. Correction of arterial structure and endothelial dysfunction in human essential hypertension by the angio- tensin receptor antagonist losartan. Circulation 2000;101:1653-1659.
- Littman MP. Spontaneous systemic hypertension in 24 cats. J Vet Intern Med 1994;8:79-86.
- Jensen J, Henik RA, Brownfield M, et al. Plasma renin activity and angiotensin I and aldosterone concentrations in cats with hypertension associated with chronic renal disease. Am J Vet Res 1997;58:535-540.
- Henik RA, Snyder PS, Volk LM. Treatment of systemic hypertension in cats with amlodipine besylate. J Am Anim Hosp Assoc 1997;33:226-234.
- Snyder PS. Amlodipine: a randomized, blinded clinical trial in 9 cats with systemic hypertension. J Vet Intern Med 1998;12:157-162.
- Maschio G, Alberti D, Janin G, et al. Effect of the angiotensin converting- enzyme inhibitor benazepril on the progression of chronic renal insuf- ficiency. The Angiotensin-Converting-Enzyme Inhibition in Progressive Renal Insufficiency Study Group. N Eng J Med 1996;334: 939-945.
- Brown SA, Brown CA, Jacobs G, et al. Effects of the angiotensin convert- ing enzyme inhibitor benazepril in cats with induced renal insufficiency. Am J Vet Res 2001;62:375-383.
- Miller RH, Lehmkuhl LB, Smeak DD, et al. Effect of enalapril on blood pressure, renal function, and the renin-angiotensin-aldosterone system in cats with autosomal dominant polycystic kidney disease. J Vet Intern Med 1999;60:1516-1525.
- Grauer GF, Greco DS, Getzy DM, et al. Effects of enalapril versus place- bo as a treatment for canine idiopathic glomerulonephritis. J Vet Intern Med 2000;14:526-533.
- Brilla CG ML, Weber KT. Antifibrotic effects of spironolactone in pre- venting myocardial fibrosis in systemic arterial hypertension. Am J Cardiol 1993;71:12-16.
- Ligtenberg G, Blankestijn PJ, Oey PL, et al. Reduction of sympathetic hyperactivity by enalapril in patients with chronic renal failure. N Engl J Med 1999;340:1321-1328.
- Atkins CE, Gallo AM, Kurzman ID, et al. Risk factors, clinical signs, and survival in cats with a clinical diagnosis of idiopathic hypertrophic car- diomyopathy: 74 cases (1985-1989). J Am Vet Med Assoc 1992;201:613- 618.
- Rush JE, Atkins CE. Vascular Disease. Small Animal Medicine. D.G. Allen (ed), J.B. Lippincott Co., Philadelphia, 1991;323-340.
Auteur

Dr. Clarke Atkins,
Dr. Vétérinaire, Dipl. ACVIM
Collège de Médecine Vétérinaire, Université d’État de Caroline du Nord, Raleigh, États-Unis
Le Dr. Atkins est diplômé de l’Université de Californie en 1972 et effectue ensuite un internat à l’Angell Memorial Animal Hospital. Il travaille actuellement à l’Université d’Etat de Caroline du Nord (NCSU), où il est professeur de Médecine et de Cardiologie. Diplômé du Collège Américain de Médecine Interne et de Cardiologie, le Dr. Atkins reçoit en 2004 le Norden Teaching Award. Ses recherches sont axées sur la dirofilariose chez le chien et le chat ainsi que sur les traitements pharmacologiques des cardiopathies chez le chien, le chat et le cheval.
Article offert par Royal Canin
Site de conseils vétérinaires